Пониженный иммунитет
 |
 |
 |
Содержание
Иммунодефицитные состояния — это группа разнообразных синдромов, обусловленных изолированными или множественными дефектами иммунной системы; характерна повышенная восприимчивость к инфекциям, приводящая к тяжелым, острым, рецидивирующим и хроническим заболеваниям.
Иммунодефицит следует подозревать у больных с частыми и тяжелыми эпизодами инфекционных заболеваний, плохо поддающихся лечению: характерны также отсутствие ремиссий, необычность возбудителей, неожиданные или тяжелые осложнения. При постановке диагноза иммунодефицита следует прежде всего исключить другие заболевания, ведущие к рецидивирующим инфекциям. Только после этого можно предположить аномалию защитных систем организма.
Различают первичные и вторичные иммунодефициты. В качестве первичных выделены такие состояния, при которых нарушение иммунных механизмов (продукции антител и/или Т-лимфоцитов) часто связано с генетическим блоком.
Первичные иммунодефицитные состояния
Первичные иммунодефицитные состояния (дефекты В- или Т-лимфоцитов, фагоцитирующих клеток или комплемента) подразделяют на четыре главные группы в зависимости от того, какой компонент иммунной системы неполноценен. Описано более 70 форм первичного иммунодефицита, причем проявления каждой из них могут значительно варьировать.
Патология Т-клеток, сочетающаяся с дефектами В-клеток (т. е. выработки антител), лежит в основе нескольких заболеваний, что вполне понятно, так как В- и Т-клетки происходят из общих первичных стволовых клеток и Т-клетки влияют на функцию В-клеток. Патология фагоцитарной системы проявляется синдромами, при которых первичный дефект затрагивает направленную миграцию клеток (хемотаксис) или же первично нарушена их бактерицидная активность.
Преобладает патология В-клеток, т. е. дефекты выработки антител; частота дефицита иммуноглобулина А (в большинстве случаев бессимптомного) достигает 1:400. Если исключить бессимптомно протекающий дефицит иммуноглобулина А, патология В-клеток составит 50% случаев первичного иммунодефицита, патология Т-клеток — около 30%, дефекты системы фагоцитов — 18%, недостаточность комплемента — 2%. Общая частота первичного иммунодефицита с клиническими проявлениями составляет 1:10000; в США регистрируется около 400 свежих случаев в год. Поскольку многие первичные дефициты бывают наследственными и врожденными, они раньше всего выявляются у детей: около 80% больных моложе 20 лет. Из-за сцепления дефекта с Х-хромосомой 70% составляют больные мужского пола.
Причины иммунодефицита
Причины возникновения иммунодефицита различны, хотя синдром часто связывают с дефектом конкретных генов. Этот дефект может приводить к отсутствию или недостатку фермента (например, аденозиндезаминазы), иного белка (например, какого-либо из компонентов комплемента) или остановке процесса клеточной дифференцировки на определенной стадии (например, на стадии пре-В-клеток при агаммаглобулинемии, сцепленной с Х-хромосомой). Некоторые заболевания могут быть связаны с нарушениями внутриутробного развития (при алкоголизме матерей, в некоторых случаях синдрома Ди Джордже и т. п.); другие — с употреблением лекарств (например, фенитоина при дефиците иммуноглобулина А). Конкретные биологические механизмы большинства заболеваний не известны.
Клиническая картина иммунодефицита
Большинство проявлений иммунодефицитных состояний сопряжено с частыми инфекциями, которые обычно начинаются рецидивирующими респираторными заболеваниями. (Однако многие дети с нормальной иммунной системой тоже по 6—8 раз в год переносят респираторные инфекции, особенно при контактах с другими детьми.) Кроме того, у большинства больных с иммунодефицитом в конце концов возникают и тяжелые бактериальные инфекции, которые персистируют, рецидивируют или приводят к осложнениям, например синуситу, хроническому отиту и бронхиту, нередко следующим за повторными ангинами или заболеваниями верхних дыхательных путей. Прогрессирующие бронхиты могут переходить в воспаление легких, вызывать бронхоэктаз и дыхательную недостаточность — наиболее частую причину смерти. Встречаются также инфекции, вызываемые условно-патогенными микроорганизмами.
Часто развиваются инфекционные поражения кожи и слизистых оболочек. Стойкий стоматит может быть первым признаком Т-клеточного иммунодефицита. Отмечаются изъязвления слизистой рта и периодонтит, особенно при недостаточности гранулоцитов. У многих взрослых больных с дефицитом антител бывают конъюнктивиты. Обычны пиодермия, облысение, экзема и телеангиэктазия.
Менее частые проявления иммунодефицита — гематологическая патология (аутоиммунная гемолитическая анемия, лейкопения, тромбоцитопения), признаки аутоиммунных заболеваний (васкулит, артрит, эндокринопатии), поражения ЦНС (например, хронический энцефалит, замедленное развитие, эпилепсия).
Необходимо собрать семейный анамнез, в котором были бы отражены сведения о случаях ранней смерти, о болезнях со сходными симптомами, об аутоиммунных и аллергических заболеваниях, об онкологических заболеваниях в раннем возрасте, с данными о степени родства. В случае положительных анамнестических находок карта родословной поможет выявить наследственный характер болезни. Следует обратить внимание на личный анамнез, в котором могут быть отмечены неадекватные реакции на иммунизации или вирусные инфекции, а также проводившиеся ранее хирургические вмешательства (например, тонзиллэктомия, аденоидэктомия), облучение тимуса или носоглотки и применявшееся в прошлом лечение антибиотиками и иммуноглобулинами, включая результаты этих воздействий.
Тип инфекции может в некоторой степени прояснить природу иммунодефицита. Так, при дефиците антител (недостаточности В-клеток) отмечается инфицирование широко распространенными грамположительными бактериями (пневмококками, стрептококками). Тяжелые заболевания, возбудителями которых могут быть вирусы, грибки и другие условно-патогенные микроорганизмы, обычны при Т-клеточном иммунодефиците.
Возраст, в котором появилось заболевание, тоже может иметь диагностическое значение. У грудных детей моложе 6 месяцев обычно встречается патология Т-клеток. Однако проявление болезни в возрасте около 6 месяцев, когда проникших через плаценту материнских антител в организме ребенка уже нет, может указывать на врожденный дефицит антител.
Физикальные данные. Люди, страдающие иммунодефицитом, часто выглядят как хронические больные. У них отмечаются бледность покровов, недомогание, истощение и напряженный живот. На коже могут быть пятнистая или пузырьковая сыпь, пиодермия, экзема, петехии; возможны также облысение или телеангиэктазии. Обычны конъюнктивиты, особенно у взрослых. Шейные лимфатические узлы, аденоиды и миндалины при В- и Т-клеточном дефиците обычно не определяются, несмотря на рецидивирующие инфекции носоглотки и гортани в анамнезе. Иногда лимфатические узлы увеличены и нагнаиваются, барабанная перепонка часто имеет рубцы и/или перфорирована. Ноздри могут быть изъязвлены и покрыты корками, что указывает на гнойные выделения из носа. Могут отмечаться капли выделений из полости носа на задней стенке глотки и сниженный рвотный рефлекс. У больных часто бывает хронический кашель. Обычны хрипы, особенно у взрослых, страдающих иммунодефицитом в течение всей жизни. Печень и селезенка часто увеличены. Мышечная масса уменьшена, так же как и отложения жира на ягодицах. У детей могут быть экскориации вокруг анального отверстия вследствие хронического поноса. При неврологическом обследовании выявляется задержка развития или атаксия.
Характерный набор диагностических признаков уже при простом осмотре позволяет диагностировать ряд синдромов иммунодефицита, в том числе — синдром Ди Джордже у новорожденных (инфекции, тетания, специфическая форма лица, врожденная патология сердца), синдром Вискотта—Олдрича у мальчиков (пиогенные инфекции, экзема, кровоточивость), атаксия-телеангиэктазия у детей (рецидивирующие инфекции придаточных пазух носа и легких, атаксия и телеангиэктазии), синдром Джоба—Бакли у рыжеволосых девочек с повышенным уровнем иммуноглобулина Е (белизна кожи, экзема и рецидивирующие стафилококковые поражения). Эти заболевания будут отдельно рассмотрены позже.
Дополнительные методы диагностики
Во всех случаях для подтверждения или установления диагноза иммунодефицита необходимы специальные анализы. Часто нужны бывают более современные методы диагностики для классификации заболеваний и назначения адекватной терапии.
Как правило, первичный скрининг может быть проведен в большинстве обычных лечебных учреждений, а более сложные анализы — в крупных больницах. Некоторые анализы осуществимы только в специальных иммунологических лабораториях или в больницах, имеющих такие лаборатории. При подозрении на иммунодефицит рекомендуется проведение ряда первичных исследований, в том числе дифференциального подсчета клеток крови и тромбоцитов, определения иммуноглобулина С, и А, функциональной оценки антител и выявления инфекций. Подсчет клеток крови позволит диагностировать анемию, тромбоцитопению, нейтропению или лейкоцитоз. Следует обратить внимание на абсолютную численность лимфоцитов; лимфопения (менее 1500/мкл) позволяет предположить Т-клеточный иммунодефицит. Необходимо исследовать мазки периферической крови на присутствие эритроцитарных телец Хауэлла—Жолли и других нетипичных форм эритроцитов, указывающее на асплению или ослабление функции селезенки.
Принципы лечения иммунодефицитов
Возможности предупреждения первичного иммунодефицита ограничены генетическими консультациями в тех случаях, когда известен характер его наследования.
Общие принципы ухода. Больные с иммунодефицитом нуждаются в чрезвычайно заботливом и внимательном уходе для поддержания на оптимальном уровне их самочувствия и питания, в предупреждении эмоциональных стрессов, связанных с болезнью, в защите от инфекций и в финансовом обеспечении. Они должны быть защищены от нежелательного инфицирования, иметь отдельную постель и, желательно, отдельную комнату. Если сохраняется какая-то способность к выработке антител, следует регулярно применять убитые вакцины. Необходимо тщательно следить за состоянием зубов.
Антибиотики имеют при лечении инфекций жизненно важное значение; их подбор и дозы не отличаются от обычных. Поскольку, однако, больной с иммунодефицитом может при инфекции быстро погибнуть, лихорадку и другие подобные проявления сразу считают признаками инфекционного заболевания и немедленно начинают лечение антибиотиками. Одновременно делают посевы микрофлоры из глотки, крови и выделений организма; это особенно важно ввиду того, что возбудитель может оказаться необычным или же нечувствительным к первоначально использованному антибиотику.
При иммунодефицитах часто полезным бывает непрерывное профилактическое применение антибиотиков, особенно в тех случаях, когда имеется риск внезапного появления скоротечной инфекции (например, при синдроме Вискотта—Олдрича, синдромах асплении) или когда иммунотерапевтические подходы недоступны (например, при дефектах фагоцитарной системы) либо неэффективны (например, при рецидивирующей инфекции у больных агаммаглобулинемией, безуспешно леченных препаратами иммуноглобулинов); или же, наконец, при большом риске появления какой-то определенной инфекции.
ПРЕДОСТЕРЕЖЕНИЕ. Для лечения больных, страдающих В- или Т-клеточным иммунодефицитом, не следует использовать живые вакцины (например, полиомиелитную, коревую, паротитную, против краснухи, БЦЖ) из-за риска вызвать вакцинную болезнь. Членам семьи больного тоже не следует назначать живую полиомиелитную вакцину.
Больные с клеточным иммунодефицитом не должны получать компоненты свежей крови, которые могут содержать интактные лимфоциты, из-за риска реакции «трансплантат против хозяина». Поэтому цельную кровь или ее компоненты (например, эритроциты, тромбоциты, гранулоциты и плазму) нужно облучать в дозе 15—30 Гр (1500—3000 рад) перед переливанием. Обычно следует избегать использования препаратов иммуноглобулина или плазмы для лечения больных с избирательным дефицитом иммуноглобулина А, так как это может вызвать появление антител к иммуноглобулина А или нежелательные реакции. Больные со спленомегалией должны воздерживаться от занятия спортом. При тромбоцитопении следует избегать внутримышечных инъекций (например, препаратов иммуноглобулина). При хирургических вмешательствах или лечении зубов необходимо применять антибиотики.
Препараты иммуноглобулинов эффективны при заместительной терапии большинства форм дефицита антител. Они представляют собой, например, 16,5% раствор иммуноглобулина С со следами иммуноглобулина М и А, используемый для внутримышечного введения, или 3—6% раствор для внутривенных вливаний. Обычная насыщающая доза составляет 200 мг/кг (1,4 мл/кг 16,5% раствора, 4 мл/кг 5% раствора), а затем с месячными интервалами вводят по 100 мг/кг (0,7 мл/кг 16,5% раствора или 2 мл/кг 5% раствора). Меньшие дозы не дают лечебного эффекта. Рекомендуемые дозы препаратов иммуноглобулинов повышают содержание иммуноглобулина С в сыворотке примерно лишь до 200 мг%; некоторым больным приходится вводить большие дозы препарата или же применять его чаще. Наивысшая доза при внутримышечном введении в один участок тела составляет 10 мл для взрослых и 5 мл для детей. Поэтому при необходимости вводить большие дозы препарат инъецируют в разные участки тела. Внутривенно иммуноглобулин можно вводить в больших дозах (400—800 мг/кг/мес); это показано некоторым больным, на обычные дозы не реагирующим, особенно при хронических заболеваниях легких. Цель внутривенного введения иммуноглобулина — поддержание уровня иммуноглобулина С в пределах нормы (т. е. более 500 мг%).
Альтернативным средством может служить плазма крови, но из-за риска передачи инфекционных заболеваний ее используют редко. Кроме иммуноглобулинов, плазма содержит много других факторов и представляет особую ценность для больных, страдающих энтеропатией с потерей белков, недостаточностью компонентов комплемента и упорными поносами. Плазму доноров, дефицитных в отношении иммуноглобулина А, успешно вводят больным с повышенной чувствительностью к иммуноглобулина А, содержащемуся в препаратах иммуноглобулина.
Другие виды лечения. Иммуностимуляторы, в том числе фармакологические (левамизол, изопринозин), биологические (препараты трансфер-фактора, интерлейкины, интерфероны) и гормоны (тимусные) играют лишь ограниченную роль в лечении Т- и В-клеточного или фагоцитарного иммунодефицита. Трансплантация тимуса плода и эпителиальных клеток тимуса иногда дает хорошие результаты, особенно при пересадке тимуса от плода при синдроме Ди Джордже. Некоторым больным с дефицитом аденозиндезаминазы с успехом вводили фермент коровы, конъюгированный с полиэтиленгликолем.
Трансплантация. Полная коррекция иммунодефицита часто достигается трансплантацией костного мозга. При тяжелом комбинированном иммунодефиците и его вариантах пересадка костного мозга от идентичных по НЬА и совместимых (судя по результатам смешанной культуры лимфоцитов) доноров-сибсов привела к восстановлению иммунитета более чем в 100 случаях. У больных с интактным или частично сохранившимся клеточным иммунитетом или с частичным клеточным иммунодефицитом (например, при синдроме Вискотта—Олдрича) необходимо проводить предварительную иммуносупрессию, чтобы обеспечить приживление трансплантированных клеток. При отсутствии совместимого донора-сибса трансплантируют костный мозг, взятый от гаплоидентичных (по полу совместимых) доноров — родителей больного. В этом случае из костного мозга должны быть удалены зрелые Т-лимфоциты, вызывающие реакцию «трансплантат против хозяина»; это достигается агглютинацией пектинами из соевых бобов или с помощью моноклональных антител к Т-клеткам. Эти специализированные методы осуществимы не во многих медицинских центрах.
Основные синдромы иммунодефицита
1. Иммунодефициты, обусловленные нарушением гуморального звена иммунной системы.
Транзиториая гипогаммаглобулинемия грудных детей
Временная недостаточность антител у детей обоего пола, проявляющаяся в возрасте от 3 до б мес.; обычно продолжается 6—18мес. Иногда заболевание сопряжено с повышенной частотой инфекции. Оно возникает в результате задержки начала синтеза иммуноглобулинов, несмотря на нормальную численность В-клеток. Число Т-хелперов может быть снижено. Недоношенные дети имеют особенно большой риск заболеть, поскольку при рождении у них понижено количество трансплацентарных иммуноглобулина С. Болезнь не носит семейного характера.
Лечение. Несмотря на низкое содержание иммуноглобулина С (менее 400 мг), большинству больных детей вводить иммуноглобулин не нужно, особенно в тех случаях, когда имеются признаки функциональной активности антител и содержание иммуноглобулина С повышается, а инфекция отсутствует или носит тривиальный характер. Больные, которым показано введение иммуноглобулина, должны получать полные терапевтические дозы в течение 3—6 мес с повторными анализами содержания иммуноглобулина С. Антибиотики показаны в каждом случае инфекции. Прогноз вполне благоприятный. Новорожденные, появляющиеся на свет до 32 недель беременности и/или массой менее 1500 г, имеют заведомо столь низкое содержание иммуноглобулина С, что им вводят иммуноглобулин в/в для лечения возможного бактериального сепсиса или предупреждения бактериальной инфекции в первые месяцы жизни.
Агаммаглобулииемия, сцепленная с Х-хромосомой (агаммаглобулинемня Брутона, врожденная агаммаглобулинемня)
Пангипогаммаглобулинемия мальчиков характеризуется низким содержанием 1% (3 (менее 100мг), низким содержанием или отсутствием других иммуноглобулинов, неизмененным клеточным иммунитетом и вспышками инфекций в возрасте старше б мес, когда материнские антитела исчезают. Эти дети часто страдают от вызванных пневмококком, гемофильной палочкой или стрептококком гнойных процессов в легких и придаточных пазухах носа. Они восприимчивы также к вакцинному штамму вируса полиомиелита и могут страдать хроническим ЕСНО-вирусным энцефалитом. У некоторых детей развивается полиартрит, исчезающий после лечения препаратами иммуноглобулинов. Наследование, сцепленное с Х-хромосомой, доказано приблизительно у 20% больных. Генетический дефект, по-видимому, состоит в невозможности дифференцировки В-клеток из пре-В-клеток.
Лечение заключается в том, что больному на протяжении всей его жизни вводят препараты иммуноглобулинов в/м или в/в в дозах, достаточных для предотвращения рецидивирующих инфекционных заболеваний. Решающее значение имеет быстрое применение антибиотиков в случае инфекции: иногда показано их постоянное использование. Несмотря на принимаемые меры, многие больные продолжают страдать хроническими синуситами, бронхитами и бронхоэктазами. У всех больных повышен риск злокачественных новообразований.
Простой вариабельный иммунодефицит (приобретенная агаммаглобулинемня).
Заболевание гетерогенного характера; встречается в равной степени у лиц обоего пола и характеризуется рецидивирующими бактериальными инфекциями на втором или третьем десятилетии жизни вследствие низкого содержания иммуноглобулинов и антител. Нормальная численность В-клеток отличает этот синдром от агаммаглобулинемии, сцепленной с Х-хромосомой. Клеточный иммунитет обычно не затронут, но у некоторых больных может быть ослаблен. Описаны также нарушения иммунорегуляторной функции Т-клеток, причем у таких больных и их родственников обычны аутоиммунные расстройства, в том числе болезнь Аддисона, тиреоидит и ревматоидный артрит. Иногда отмечаются поносы, нарушение всасывания в кишечнике, гиперплазия лимфатических узлов желудочно-кишечного тракта. Часто развивается бронхоэктазия. Нарушения иммунной системы проявляются у разных больных неодинаково; например, отмечаются повышенная активность Т-супрессоров, дефицит активности Т-хелперов, первичный дефект функции В-клеток и появление аутоантител к В- или Т-клеткам.
Лечение: как и при агаммаглобулинемии, сцепленной с Х-хромосомой, необходимо введение (в течение всей жизни больного) препаратов иммуноглобулинов; при инфекциях следует применять антибиотики.
Синдром, сопровождающийся повышенной восприимчивостью к инфекции; характерно отсутствие или резкое уменьшение количества антител одного или двух подклассов тогда как содержание антител других подклассов остается в пределах нормы или повышено. У большинства больных общее содержание иммуноглобулина С и других иммуноглобулинов нормально или почти нормально, но гуморальный ответ на некоторые антигены снижен. У больных встречаются хронические инфекции дыхательных путей, воспаление среднего уха, хронические заболевания легких и рецидивирующий менингит. Поскольку на подкласс иммуноглобулина С1 приходится 70% всех избирательный дефицит иммуноглобулина С1 приводит к пангипогаммаглобулинемии и не рассматривается как дефицит конкретного подкласса. Избирательный или комбинированный дефицит иммуноглобулина С2 или иммуноглобулина СЗ в сочетании с дефицитом иммуноглобулина С4 или без него — наиболее часто встречающийся дефицит подклассов иммуноглобулина 0. У больных с дефицитом иммуноглобулина С2 (избирательным или в сочетании с дефицитом других подклассов) часто отмечают сниженную выработку антител к полисахаридным антигенам и/или дефицит иммуноглобулина А (менее 15 мг). На больных с подтвержденным диагнозом дефицита подклассов благоприятное действие могут оказывать препараты иммуноглобулинов. Дефицит подклассов у детей младшего возраста может быть временным и проходить с возрастом. Описаны отдельные больные с пониженным иммунным ответом на полисахариды, но с нормальным содержанием подклассов иммуноглобулина С.
Избирательный иммунодефицит
Отсутствие или резкое снижение (менее 15мг) сывороточного иммуноглобулина А при нормальном содержании других иммуноглобулинов и интактном клеточном иммунитете. Избирательный дефицит иммуноглобулина А — наиболее частая (и самая легкая) форма иммунодефицита (частота до 1:400); обычно это спорадическое, но изредка — семейное заболевание. Оно может быть следствием приема фенитоина и, кроме того, встречается улиц с аномалиями 18-й пары хромосом, а также у родственников больных, страдающих простым вариабельным иммунодефицитом.
У большинства людей болезнь протекает бессимптомно и обнаруживается случайно. Иногда отмечают рецидивирующие респираторные инфекции, хронические поносы, аллергические или аутоиммунные заболевания. В секретах не выявляется, и его недостаточность может компенсироваться секрецией других иммуноглобулинов. После контакта с вводимым с плазмой крови или препаратами иммуноглобулинов, у больных могут появляться антитела к 1§Д, и они могут быть причиной анафилактических реакций при повторном введении препаратов иммуноглобулина или переливании крови. У некоторых больных с дефицитом иммуноглобулина А отмечается также дефицит подкласса иммуноглобулина С2; многие из этих больных страдают рецидивирующими инфекциями.
Лечения обычно не требуется. Больным рекомендуется носить браслет с основными медицинскими данными, чтобы предупредить случайное введение плазмы крови или препаратов иммуноглобулинов, которое может привести к сенсибилизации и нежелательным реакциям. При длительно текущих респираторных инфекциях необходимы антибиотики. Препараты иммуноглобулина А для заместительной терапии не производятся. Введение препаратов иммуноглобулинов обычно противопоказано, хотя при сопутствующем дефиците подклассов их в ряде случаев с успехом использовали. У некоторых больных дефицит проходит без лечения.
Синдром Ди Джордже (гипоплазия тимуса, синдром третьего и четвертого глоточных карманов)
Врожденный иммунодефицит, для которого характерны гипокальциемическая тетания, врожденная патология сердца, специфическая форма лица, повышенная восприимчивость к инфекциям, отсутствие или гипоплазия тимуса и паращитовидных желез, частичный или полный Т-клеточный иммунодефицит при нормальном или почти нормальном В-клеточном иммунитете. Больные дети имеют низко посаженные уши, расщепление по средней линии лица, недоразвитую нижнюю челюсть, гипертелоризм (деформированный череп) и укороченный продольный желобок между носом и верхней губой. Тетания начинает проявляться спустя 1—2 сут. после рождения. Дети обоих полов поражаются одинаково; заболевание обычно не связано с генетическими факторами (однако есть единичные сообщения об аномалиях хромосомы 22). Рецидивирующие инфекции появляются уже вскоре после рождения. Количество лимфоцитов в периферической крови снижается, падает их функциональная активность. Концентрации различных классов находятся в пределах нормы; в ряде случаев отмечается повышение уровней.
Этиология заболевания, по-видимому, связана с нарушениями нормального развития производных глоточных карманов приблизительно на 8-й неделе внутриутробной жизни под влиянием ряда факторов (таких, как алкоголизм матери). Степень иммунодефицита значительно варьирует у разных больных; иногда функция Т-клеток спонтанно улучшается.
Лечение. В ряде случаев хорошие результаты давала трансплантация костного мозга; некоторое улучшение достигалось при пересадке фетального тимуса. Общий прогноз зависит от тяжести поражения сердца. При неполном дефиците больные живут дольше.
Синдромы недостаточности селезенки
Восприимчивость к инфекциям после спленэктомии, при врожденном отсутствии селезенки, функциональной асплении в результате тромбоза сосудов селезенки (при серповидно-клеточной анемии) или инфильтративных заболеваний (при болезнях накопления). Селезенка — один из главных органов ретикулоэндотелиальной системы (системы мононуклеарных фагоцитов), захватывающих микроорганизмы из крови. Селезенка служит также важнейшим местом синтеза антител. Лица, лишенные селезенки, особенно грудные дети, подвержены быстро прогрессирующим бактериальным инфекциям, вызываемым пневмококком, стрептококком и в меньшей степени другими микроорганизмами. Эти больные должны непрерывно получать антибиотики с профилактической целью по меньшей мере в первые 2—3 года жизни, а затем — в каждом случае повышения температуры и при хирургических вмешательствах. Следует также иммунизировать больных вакцинами на основе пневмококковых и менингококковых полисахаридов и антигенов гемофильной палочки.
Иммунодефнциты, вызванные потерями белка (при нефрозах, ожогах, энтеритах)
Потеря белков плазмы крови, ведущая к вторичному дефициту антител с резко выраженной гипогаммаглобулинемией. Потеря белков происходит через почки (нефротический синдром), кожу (при тяжелых ожогах или дерматите) или ЖКТ (при энтеропатии с потерей белка, кишечной лимфангиэктазии). Одновременно теряются альбумин и другие белки плазмы. Переход белков сквозь стенку ЖКТ может сопровождаться потерей лимфоцитов, приводящей к лимфопении и клеточному иммунодефициту. Такие больные восприимчивы к заражению распространенными грамположительными бактериями, но поскольку происходит компенсаторное повышение выработки антител, заболевания возникают сравнительно редко, несмотря на выраженную гипо-гаммаглобулинемию. Устранение причин потери белка приводит и к коррекции иммунодефицита. Если устранить основное заболевание невозможно, применяют триглицериды со средней длиной цепей, которые могут приносить некоторую пользу, снижая потерю иммуноглобулинов и лимфоцитов через ЖКТ.
2. Иммунодефицит с преимущественным нарушением клеточного звена иммунитета.
Хронический кандидоз слизистых и кожи
Клеточный иммунодефицит с персистирующим поражением слизистых оболочек, кожи, волосистой части головы и ногтей грибами рода Кандида; часто связан с эндокринопатией, особенно гипотиреозом. Болезнь может возникнуть в грудном возрасте с появления стойкой молочницы, или же ее начало отодвигается до позднего зрелого возраста. Несколько чаще заболевают женщины. Тяжесть болезни значительно варьирует — от поражения ногтя на одном пальце до генерализации инфекции, когда могут поражаться слизистые оболочки, кожа и волосы с образованием грануляций, обезображивающих лицо и волосистую часть головы. Системного кандидоза и повышенной восприимчивости к другим инфекциям не отмечается. Существует несколько клинических форм, включая аутосомно-рецессивное заболевание, связанное с гипоплазией паращитовидных желез и аддисоновой болезнью (синдром кандидоза с эндокринопатией). Характерные иммунологические признаки: отсутствие кожных реакций и пролиферативного ответа лимфоцитов на антиген грибов Кандида (при нормальной бласттрансформации на митогены) и нормальная выработка антител к этому и другим антигенам. Сопутствующими симптомами в некоторых случаях могут быть бронхоэктатическая болезнь, гепатит и недостаточность биотина в сочетании с дефицитом карбоксилазы.
Для лечения используют противогрибковые препараты местного действия (нистатин, клотримазол) или системного действия (кетоконазол, флюконазол, амфотерицин В). Пораженные ногти иногда приходится удалять. Иммунотерапия с применением препаратов трансферфактора, эпителия тимуса, гормонов тимуса или иммунных лимфоцитов не дает длительного эффекта. В одном случае хороший результат был получен при трансплантации костного мозга.
В настоящее время ряд фирм производит препараты нормальных иммуноглобулинов, содержащие иммуноглобулина А; таков, например, пентаглобин фирмы «Биотест» (Германия).
Синдром иммунодефицита с повышенным содержанием (синдром Джоба— Бакли)
Синдром характеризуется рецидивирующей стафилококковой инфекцией, особенно кожной, и необычно высоким содержанием иммуноглобулина Е. В некоторых случаях болезнь наследуется по аутосомно-доминантному типу. Стафилококковая инфекция может поражать кожу, легкие, суставы и другие органы. Нередко больные имеют грубые черты лица, иногда отличаются белизной кожи и рыжими волосами. Часто отмечается остеопороз с повторными переломами костей. У многих больных нарушен хемотаксис нейтрофилов. У всех исключительно высокое содержание иммуноглобулина Е (более 1000 МЕ/мл). Иногда встречаются аллергические заболевания (например, экзема, ринит, астма). Кроме того, в лабораторных исследованиях выявляются специфические аномалии Т- и В-клеточного иммунитета, эозинофилия тканей и периферической крови. Основной дефект состоит в нарушении иммунорегуляторной функции Т-клеток.
Лечение заключается в применении антибиотиков — постоянно или курсами. Особенно эффективным профилактическим средством служит триметоприм/сульфаметоксазол.
Иммунодефицит и недостаточное питание
Недостаточное питание, приводящее к иммунодефициту и инфекциям — самая распространенная в мире причина детской смертности. Истощение может быть обусловлено дефицитом всех питательных веществ (кахексия) или преимущественно белка (квашиоркор). При этом дистрофия обычно усугубляется нехваткой витаминов и минеральных веществ (например, витамина А, железа и цинка). Когда вес тела снижается до уровня менее 80% от расчетной средней, отмечается некоторое ослабление иммунологических функций, а при соответствующей величине менее 70% оно обычно становится резко выраженным. Большинство таких больных (за исключением страдающих невропатической анорексией) необычайно восприимчивы к респираторным инфекциям, вирусным заболеваниям и гастроэнтериту. Эти инфекции, усиливая метаболические процессы и снижая аппетит, приводят к еще большей недостаточности питания и большему иммунодефициту, замыкая тем самым порочный круг. Плохое питание, связанное с низким жизненным уровнем, — основная причина распространения дистрофии; реже последняя бывает связана с воздержанием от пищи (например, строгое вегетарианство), хроническими заболеваниями (болезнь оперированного кишечника, колиты и т. п.), психическими расстройствами (анорексия). Иммунологические нарушения в основном связаны с Т-клеточным иммунодефицитом, для которого характерны кожная анергия, низкая численность Т-клеток, их слабый пролиферативный ответ на митогены и антигены, пониженная цитотоксическая активность и дефицит образования лимфокинов (интерферона). Количества секреторных антител могут быть снижены, по содержание сывороточных иммуноглобулинов, особенно иммуноглобулин Е, обычно неизменено или повышено. Выраженность патологии иммунной системы зависит от степени и длительности дистрофии и от сопутствующих заболеваний (например, от инфекций и от специфических форм алиментарной недостаточности). После нормализации питания иммунологические нарушения быстро исчезают.
3. Комбинированный иммунодефицит (КИД).
Синдром Вискотта—Олдрича
Рецессивное сцепленное с Х-хромосомой заболевание мальчиков; характеризуется экземой, тромбоцитопенией и рецидивирующими инфекциями. Часто первым симптомом бывает кровоточивость (обычно кровавые поносы), затем появляются рецидивирующие респираторные инфекции. У детей, проживших более 10 лет, нередко возникают злокачественные новообразования (особенно лимфомы и острые лимфобластные лейкозы). Характерные иммунологические дефекты: сниженная выработка антител к полисахаридным антигенам, кожная анергия, умеренный Т-клеточный иммунодефицит, повышенное содержание иммуноглобулина Е и А, низкое содержание иммуноглобулин М и ускоренный катаболизм иммуноглобулина О при нормальном его уровне. Вследствие сочетанного дефицита функций Т- и В-клеток развиваются инфекции, вызываемые пиогенными бактериями, вирусами и грибами. Гематологическое исследование выявляет тромбоциты уменьшенных размеров и повышенную их деструкцию в селезенке; поэтому спленэктомия может уменьшить тромбоцитопению.
Лечение состоит в удалении селезенки, постоянном применении антибиотиков, введении препаратов иммуноглобулинов (внутривенно, а не внутримышечно из-за риска кровоизлияния), трансплантации костного мозга.
Атаксия-телеаигиэктазия (синдром Луи-Бар)
Аутосомно-рецессивное прогрессирующее мультисистемное заболевание, характеризующееся мозжечковой атаксией, телеангиэктазией конъюнктивы и кожи, рецидивирующими инфекциями легких и придаточных пазух носа и различными иммунологическими нарушениями, высоким риском развития опухолей.
Неврологические симптомы, как и признаки иммунодефицита, появляются рано. Атаксия обычно развивается тогда, когда ребенок начинает ходить, с возрастом отмечается неуклонно прогрессирующее течение мозжечкового симптомокомплекса, который сменяется стриопаллидарным. Прогрессирующая атаксия ведет к тяжелой инвалидизации. Речь становится невнятной, у пациентов отмечается выраженная гипотония, интенция, гипомимия, нарастающая мозжечковая атаксия, мышечная слабость, гиподинамия. По мере прогрессирования процесса мозжечковый симптомокомплекс сменяется стриопаллидарным — гипотония сменяется пластическим гипертонусом, нарастает гипокинезия, гипомимия. Телеангиэктазии проявляются в возрасте 2—4 лет, вначале локализуются на бульбарной конъюнктиве, позже появляются на коже ушных раковин, щек, в межлопаточной области. Для синдрома характерен выраженный иммунодефицит, который проявляется на первом году жизни частыми рецидивирующими инфекциями, имеющими затяжное, прогрессирующее течение. У пациентов с синдромом Луи—Бар на первом году жизни отмечаются отиты, пневмонии, бронхиты. В последующем повторные инфекции придаточных пазух носа и легких, связанные с иммунодефицитом, приводят к рецидивирующей пневмонии, бронхоэктазу и хроническим легочным заболеваниям вследствие закупорки или ограниченной проходимости воздухоносных путей. Нередко воспалительные процессы могут осложняться абсцедирующей пневмонией или сепсисом и быть причиной гибели больных. Могут развиваться эндокринопатии с торможением гаметогенеза, атрофией яичек и необычной формой сахарного диабета, для которой характерны выраженная гипергликемия, устойчивость к кетозу и повышенный выброс инсулина при введении глюкозы или толбутамида.
При атаксии-телеангиэктазии отмечается высокая частота злокачественных заболеваний (особенно лейкоза, опухолей головного мозга и рака желудка), что связано с высокой частотой хромосомных аберраций, нарушением процессов репарации ДНК, иммунодефицитом и низким порогом чувствительности к внешнесредовым воздействиям. Высокая частота опухолей характерна не только для больных, но и для гетерозиготных носителей патологического гена. Так, для родителей риск развития неоплазии в 7—8 раз превышает общепопуляционный. Опухоли у них могут развиваться любой локализации, но наиболее часто у матерей развивается рак грудной железы, а у отцов — карцинома желудка. Поэтому для гетерозиготных носителей патологического гена должен проводиться селективный скрининг на выявление опухолевого роста и разрабатываться индивидуальная тактика ведения, направленная на предупреждение развития неоплазии. У многих больных отсутствуют иммуноглобулины А и Е, наблюдается кожная анергия и прогрессирует нарушение клеточного иммунитета. Содержание альфа-фетопротеина в сыворотке обычно повышено.
Лечение пациентов с синдромом Луи-Бар — симптоматическое, оно включает антибиотикотерапию, иммуномодуляторы, препараты, направленные на уменьшение неврологических проявлений заболевания. Учитывая онкогенетический характер патологии, важное значение приобретает профилактика развития неоплазий как для больных, так и для гетерозиготных носителей патологического гена. Из комплекса терапии исключаются биостимуляторы, назначение физиотерапии (ультрафиолетовое облучение, электрофизиотерапия), инсоляция. Течение заболевания неуклонно прогрессирующее, приводящее к летальному исходу в первое, реже второе десятилетие жизни. Лечение препаратами иммуноглобулинов приносит некоторую пользу, но эффективной терапии при поражении ЦНС не существует. Поэтому неврологические расстройства продолжают развиваться, приводя к хореоатетозу, мышечной слабости, деменции и, наконец, смерти.
4. Иммунодефициты, обусловленные нарушением функции лейкоцитов.
Хронический гранулематоз
Наследственное нарушение бактерицидной функции лейкоцитов. Характерные особенности: множественные гранулемы кожи, легких и лимфатических узлов; гипергаммаглобулинемия, анемия, лейкоцитоз. Большинство больных — мальчики, заболевание наследуется как рецессивный признак, сцепленный с Х-хромосомой. У единичных больных обоего пола наследование аутосомно-рецессивное.
Клинически болезнь проявляется в виде рецидивирующих инфекций микроорганизмами, вырабатывающими каталазу, которые обычно гранулем не вызывают, но при дефектной функции фагоцитов остаются внутри этих клеток жизнеспособными. Болезнь обычно начинается в раннем детстве, но изредка ее проявление задерживается до подросткового возраста. Клиническая картина включает гнойный лимфаденит, гепатоспленомегалию, пневмонию и изменения гемограммы, указывающие на хронические инфекции. Отмечаются также ринит, дерматит, поносы, перианальные абсцессы, стоматит, остеомиелит, абсцессы мозга, нарушения проходимости желудочно-кишечного и мочеполового трактов (из-за образования гранулем), задержка роста.
Лечение заключается в периодическом или постоянном применении антибиотиков. Эффективной оказалась и трансплантация костного мозга. Сейчас испытывается метод лечения гамма-интерфероном.
Недостаточность адгезии лейкоцитов.
Аутосомно-рецессивная патология, которая проявляется рецидивирующей или прогрессирующей инфекцией, вызывающей некрозы мягких тканей; периодонтитом, вялым заживлением ран, лейкоцитозом и задержкой (дольше трех недель) отделения пуповины. При выраженной недостаточности дети страдают множественными инфекциями с быстро прогрессирующим течением. Выявлены также больные с менее тяжелой формой заболевания. Лечение состоит в интенсивном (часто постоянном) применении антибиотиков.
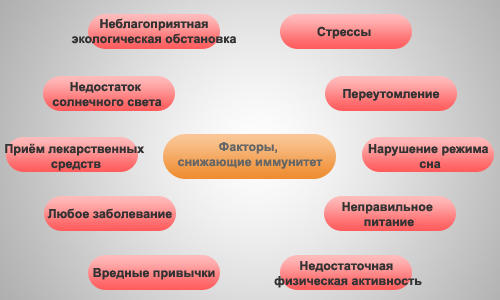
Иммунитет и стресс
К факторам стресса, по материалам ВОЗ, в настоящее время относятся интоксикация, травма, инфекционный процесс, длительная или интенсивная физическая либо психическая нагрузка, резкие колебания температуры окружающей среды, голодание и др. История развития теории стресса (по Г. Селье) насчитывает более 50 лет. Одним из первых факторов, выявленных при изучении развития стрессорных реакций, было то, что при действии большого числа различных по природе факторов, выходящих за пределы физиологического стимула, происходят активация деятельности передней доли гипофиза, увеличение секреции надпочечниками стероидных гормонов и, как следствие этого инволюция лимфоидных органов и лимфопения. По мнению Г. Селье, данная реакция представляет собой стереотипное соматическое выражение мобилизации защитных сил организма. При этом в ходе процесса при его значительной продолжительности может происходить или адаптация к действию повреждающего агента, или полная утрата резистентности вплоть до гибели организма.
Тимус и другие лимфоилные органы очень быстро реагируют на стрессорное воздействие, что обнаружено в эксперименте на животных и у человека. Возникающие при хроническом стрессе изменения в лимфоидной ткани могут являться: а) фактором, способствующим канцерогенезу; б) фактором, способствующим развитию инфекций; в) фактором, способствующим развитию аутоиммунного процесса.
Наиболее ранним признаком развивающейся стрессовой реакции у экспериментальных животных является уменьшение массы тимуса, селезенки и лимфатических узлов. В крови снижается число Т- и В-лимфоцитов, в которых определяются признаки дегенеративных изменений. Показана динамика эмиграции Т- и В-лимфоцитов, сначала в первые часы из лимфоидных органов в кровоток, затем из крови в костный мозг, что проявляется в лимфопении. Вследствие этой эмиграции в костном мозге увеличивается число стволовых клеток и предшественников В-лимфоцитов, мобилизуется гранулоцитарный ряд.
Таким образом, наиболее заметным событием, возникающим в иммунной системе в начальном периоде стрессовой реакции, являются: а) перемещение большой массы клеток; б) усиленная эмиграция лимфоцитов из тимуса и селезенки; активация процессов грануло- и В-лимфопоэза в костном мозге; лимфопения в периферической крови.
Дальнейшие исследования выявили зависимость реакции иммунной системы от генетического статуса и возраста организма, т. е. и в отношении реакции на стрессорное воздействие существуют низко- и высокореагирующие люди.
Снижение числа иммунокомпетентных лимфоцитов в крови сопровождается иммуносупрессивным эффектом, коррелирующим с уровнем стероидных гормонов в плазме крови. Так, показано избирательное снижение у экспериментальных животных иммунитета к вирусам герпеса, полиомиелита и везикулярного стоматита. Интенсивность первичного и вторичного иммунного ответа уменьшается, если антиген введен одновременно со стрессорным фактором. Выявлено снижение цитотоксической и киллерной функции Т-лимфоцитов, равно как и активности НК-клеток, т.е. противовирусный, противомикробный и противоопухолевый иммунитет.
Было выявлено, что стрессовая реакция сопровождается фазными изменениями иммунного статуса, выраженность которых имеет индивидуальные особенности. Начальный период острого стресса характеризуется значительным снижением противоинфекционного и противоопухолевого иммунитета. Затем наступает фаза кратковременной гиперактивности иммунного ответа, опасной для развития аутоиммунных и аллергических болезней. Хронический стресс неизбежно приводит к формированию вторичного иммунодефицита, опасного в отношении формирования онкологических, аутоиммунных, инфекционных заболеваний или обострения хронической патологии. Прекращение стресса на известном этапе может привести к восстановлению иммунного ответа.
Поскольку в результате стресса страдает иммунологический надзор за развитием злокачественных новообразований, было проведено специальное изучение влияния стресса на индукцию и рост различных экспериментальных опухолей у животных. При этом была выявлена некоторая закономерность: приживляемость опухолевых клеток, введенных подкожно, значительно увеличивалась во время стресса, падала до нормы через несколько суток, а к 18-м суткам была значительно ниже нормы и постепенно возвращалась к обычным величинам.
Согласно докладу экспертов ВОЗ (1978), иммунологическая недостаточность, инволюция лимфоидных тканей и лимфопения, наблюдаемая у человека при истощении (голодание), тяжелые инфекции, травмы и нарушения от других стрессорных факторов представляют самостоятельную группу приобретенных, или вторичных иммунодефицитов. Клиническими последствиями их могут явиться:
• частые, тяжелые или атипично протекающие инфекционные процессы любой локализации;
• увеличение частоты новообразований;
• развитие аутоиммунных заболеваний.
Иммунная система при старении
С возрастом снижаются реакции клеточного иммунитета, уменьшается концентрация иммуноглобулина А в секретах — отсюда высокая чувствительность к инфекциям слизистых оболочек. Падают титры изогемагглютининов, антистрептолизина-О и антител к возбудителям инфекционных заболеваний. Во многом это связано с тем, что с возрастом в большей степени страдает контакт с антигеном, его переработка и распознавание. Значительно угнетается пролиферативная активность Т-клеток, уменьшается абсолютное количество лимфоцитов, начинает преобладать супрессорная активность. Эти сдвиги, очевидно, связаны со снижением с возрастом уровня сывороточного тимического фактора.
Повышаются титры аутоиммунных антител: к ДНК, антигенам щитовидной железы. Экзогенные антигены и повышение степени сенсибилизации к аутоантигенам может иметь решающее значение в развитии инфекционных поражений и злокачественных опухолей.
В соответствии с иммунологической теорией старения Вальфарда в течение жизни в организме накапливаются соматические мутации, в результате которых существенно изменяются антигенные структуры тканей. Это в свою очередь приводит к реакциям, наблюдаемым при трансплантационном иммунитете, когда иммунокомпетентные клетки действуют против нормальных клеток организма.
Кроме того, при старении отмечается инволюция тимуса, а ему, как известно, принадлежит важная роль в созревании "Т- и, опосредованно, В-клеток.
Для получения более подробной информации пожалуйста пройдите по ссылке
Консультация по поводу лечения методами традиционной восточной медицины (точечный массаж, мануальная терапия, иглоукалывание, фитотерапия, даосская психотерапия и другие немедикаментозные методы лечения) проводится в Центральном районе Санкт-Петербурга (7-10 минут пешком от станции метро «Владимирская/Достоевская»), с 9.00 до 21.00, без обеда и выходных.
Уже давно известно, что наилучший эффект в лечении заболеваний достигается при сочетанном использовании «западных» и «восточных» подходов. Значительно уменьшаются сроки лечения, снижается вероятность рецидива заболевания. Поскольку «восточный» подход кроме техник направленных на лечение основного заболевания большое внимание уделяет «чистке» крови, лимфы, сосудов, путей пищеварения, мыслей и др. – зачастую это даже необходимое условие.
Консультация проводится бесплатно и ни к чему Вас не обязывает. На ней крайне желательны все данные Ваших лабораторных и инструментальных методов исследования за последние 3-5 лет. Потратив всего 30-40 минут Вашего времени вы узнаете об альтернативных методах лечения, узнаете как можно повысить эффективность уже назначенной терапии, и, самое главное, о том, как можно самостоятельно бороться с болезнью. Вы, возможно, удивитесь - как все будет логично построено, а понимание сути и причин – первый шаг к успешному решению проблемы!