Подагра (подагрический артрит)
 |
 |
 |
Содержание
- Историческая справка о подагре
- Частота подагрического артрита
- Подагра причины
- Механизм развития подагры
- Классификация подагры
- Симптомы подагры - подагрический приступ
- Описание типичного приступа подагры
- Хронический подагрический артрит
- Диагностика подагрического артрита
- Инструментальная и лабораторная диагностика подагры
- Проблемы внутренних органов при подагре
- Подагра диагностика
- Подагра лечение и прогноз
- Лечебное питание при подагре
- Медикаментозное купирование приступа подагры
- Лечение хронического подагрического артрита
Подагра — это хроническое заболевание, вызываемое нарушением мочекислого обмена, вследствие чего в крови повышается уровень мочевой кислоты и отложением в тканях уратов (кристаллов натриевой соли мочевой кислоты), что клинически проявляется периодически рецидивирующим острым артритом и образованием тофусов (подагрических узлов).
В зарубежной литературе подагра трактуется как заболевание, при котором отложение кристаллов натриевых уратов в ткани происходит из перенасыщенной внеклеточной жидкости, следствием чего является одно или несколько клинических проявлений.
Подагра является наиболее известное и распространенное заболевание из группы микрокристаллических артритов, для которых характерны выделение кристаллов в синовиальную жидкость, импрегнация ими околосуставных и суставных тканей с развитием синовитов.
Историческая справка о подагре
Гиппократ впервые описал синдром острых болей в области большого пальца стопы, который он и назвал подагрой.
Термин «подагра» означает «ловушка для стопы» (от греческих слов «podos» и «agra»).
Еще в V в. до н. э. сложились первые представления о подагре, даже появилось учение о «подагрическом диатезе».
В XVII в. Th. Sydenham уже вполне подробно описал клинические симптомы заболевания. К концу XVIII века медицина располагала сведениями о факторах провоцирующих острые приступы подагры и стимулирующих ее возникновение.
В 1859 г. A. Garrod с помощью простой пробы с ниткой убедительно продемонстрировал значение в развитии подагры гиперурикемии (нитка, опущенная в сыворотку крови больного подагрой, через 1—2 сут покрывалась кристаллами мочевой кислоты).
Несколько позже С. Gudzent дал клиническое определение подагры: «Подагра есть болезнь, характеризующаяся приступообразными острыми воспалениями суставов». A. Gutman (1950) охарактеризовал заболевание как врожденное нарушение метаболизма пуринов, выявленное наличием эссенциальной гиперурикемии, а в 1961 г. D. McCarty и J. Holland установили роль кристаллов натриевой соли мочевой кислоты в развитии острого приступа подагры.
Частота подагрического артрита
Частота выявления повышения содержания в крови мочевой кислоты (гиперурикемии) и подагры колеблется в широких пределах. Распространенность гиперурикемии в популяции составляет 4—12 % и имеет существенную тенденцию к увеличению с возрастом, особенно у женщин.
Большинство исследователей указывают на увеличение частоты заболеваемости подагрой в некоторых странах мира, преимущественно с высоким уровнем жизни. Подагрой страдает около 0,1 % населения, заболевание редко встречается у детей и женщин в пременопаузальном периоде. По данным литературы, 80—90 % больных — люди среднего и старшего возраста с предшествующей в течение 20—30 лет асимптоматической гиперурикемией.
Подагрой болеют преимущественно мужчины (95 %) в возрасте старше 40 лет.
Подобная закономерность обусловлена различным состоянием пуринового обмена и особенностями гормонального статуса. Однако в последние годы ряд исследователей отмечают повсеместный рост численности больных подагрическим артритом среди женской части населения. Выявлена обратная зависимость между уровнем эстрогенов и концентрацией мочевой кислоты. Снижение уровня этих гормонов в крови во время менопаузы способствует появлению гиперурикемии и депонированию уратов в тканях.
Анализ случаев обращения за неотложной помощью показал, что у 14,9 % больных, страдавших поражениями суставов, был зарегистрирован острый приступ подагры. Доля больных подагрой среди страдающих ревматическими заболеваниями увеличилась за последние годы до 7—8 %.
Особенностями заболевания в последние десятилетия являются дебют в более молодом возрасте, раннее формирование осложнений, частое вовлечение в процесс почек и сердечно-сосудистой системы. У молодых чаще наблюдается тяжелое течение заболевания со множественным поражением суставов, частыми и длительными обострениями, множественными тофусами и более выраженной гиперурикемией.
Подагра причины
Причина подагры. Детерминирующим фактором риска развития подагры является содержание уратов в плазме. Под гиперурикемией понимают концентрацию уратов в сыворотке выше 7,0 мг/дл (или 0,42 ммоль/л) у мужчин и выше 6,0 мг/дл (или 0,36 ммоль/л) у женщин.
Значительная агрегация подагры и гиперурикемии у родственников свидетельствует о значении генетических факторов в предрасположенности к этому заболеванию. Так, например, в Японии описано шесть поколений японской семьи с подагрическим артритом и прогрессирующей нефропатией.
Запасы мочевой кислоты в организме в норме составляют 1000 мг при скорости их обновления в пределах 650 мг/сут. Нарушение обмена пуринов может приводить к повышению уровня мочевой кислоты в крови. Источником образования мочевой кислоты в организме являются пуриновые соединения, поступающие с пищей, а также образующиеся в организме в процессе обмена нуклеотидов.
Метаболизм пуриновых оснований регулируется несколькими ферментами.
В настоящее время доказано наличие двух ферментативных дефектов, сопровождающихся усилением синтеза мочевой кислоты и развитием подагры в детском или подростковом возрасте.
Повышенное внутриклеточное разрушение АТФ (с образованием большого количества аденина), наблюдаемое при врожденных (гликогенозы, непереносимость фруктозы) и приобретенных заболеваниях и состояниях (гипоксемия, физическая нагрузка, злоупотребление алкоголем), также может приводить к гиперурикемии.
Подробный перечень факторов, способствующих гиперурикемии, приводит в своей работе Дж. Скотт (1990):
1) факторы, обусловливающие повышенное образование мочевой кислоты:
— специфические ферментные дефекты;
— снижение активности гипоксантингуанинфосфорибозилтрансферазы;
— повышение активности фосфорибозилпирофосфатсинтетазы;
— усиление обмена нуклеотидов;
— характер питания и др.;
2) факторы, обусловливающие замедление выведения мочевой кислоты:
— нарушение функции почек;
— лекарственные препараты;
— накопление кетоновых соединений;
— артериальная гипертензия;
3) другие факторы:
— раса;
— пол;
— возраст;
— нарушение липидного обмена;
— алкоголь.
Механизм развития подагры
Процессы отложения солей мочевой кислоты в тканях определяют клинические проявления подагры. Определенное значение имеет недостаточная васкуляризация тканей, что подтверждается преимущественным отложением уратов в сухожилиях и хрящах.
К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и наличие протеогликанов - субстанции удерживающей ураты в жидкости. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что способствует их кристаллизации.
Большое значение для кристаллизации мочевой кислоты имеет и рН сыворотки крови. Доказано, что полное растворение солей мочевой кислоты происходит при рН = 12,0-13,0, что невозможно устроить в живом организме. Растворимость уратов зависит от температуры окружающей среды: переохлаждение периферических суставов способствует кристаллизации уратов и образованию микротофусов.
Образование уратов натрия рассматривается как основной патологический процесс при подагрическом артрите.
К факторам, определяющим образование кристаллов, относят концентрацию уратов, локальную температуру и присутствие или отсутствие субстанций, удерживающих ураты в жидкости, главным образом протеогликанов. Концентрация уратов в синовиальной жидкости, как правило, близка к их плазменному и тканевому содержанию, но может нарастать, если в силу каких-то причин содержание воды, например в суставе, уменьшается. Повышение диффузии воды из сустава ведет к увеличению концентрации уратов, что, в свою очередь, способствует их кристаллизации. Предполагается, что на последний процесс влияет и концентрация других катионов, таких как кальций и натрий.
Одновременно в результате воспалительной активности нейтрофилов в синовиальной жидкости происходит снижение pH, что ведет к дальнейшему осаждению кристаллов уратов. Наиболее ярким проявлением этого процесса является острый подагрический артрит. В очаге воспаления снижается рН среды, что способствует еще большей кристаллизации уратов. Создается патогенетический порочный круг – выкристаллизация уратов – воспаление – снижение рН среды – еще большее высвобождение уратов – и т.д.
Подагрический артрит патоморфология
Отложения солей уратов выявляются в следующих тканях сустава: синовиальной мембране, хряще, эпифизах костей, капсуле, околосуставных тканях: сухожилиях, связках. Гистопатологические изменения, наблюдаемые в синовиальной оболочке – классические признаки воспаления, включают отложения фибрина, пролиферацию синовиальных клеток и выраженную инфильтрацию нейтрофильными лейкоцитами.
При хронической подагре поражение суставов характеризуется значительной деструкцией хряща, изменениями сухожилий, связок и синовиальных сумок, нередко выявляется и субхондральное нарушение целостности кости. При этой форме подагры происходит образование тофусов и поражение внутренних органов.
В тофусах отмечается большое скопление кристаллов уратов, окруженное гранулематозной тканью, в составе которой обнаруживаются гигантские гранулематозные многоядерные клетки. С течением времени тофусы могут кальцифицироваться, оссифицироваться.
Среди внутренних органов наиболее выраженные изменения наблюдаются в почках. Отложения уратов обнаруживают в интерстициальной ткани, в клубочках, в просвете канальцев и их стенках, в чашечках и лоханках. В интерстиции выявляется гигантоклеточная и лейкоцитарная воспалительная реакция. Изменения в клубочках (утолщение петель капилляров, умеренные клеточные инфильтраты преимущественно на периферии петель) непосредственно не связаны с отложением уратов, а являются вторичными.
Несмотря на то, что увеличение уровня мочевой кислоты является фактором риска, у многих больных с выраженной гиперурикемией подагра не развивается.
Следовательно, в развитии подагры наряду с гиперурикемией имеют значение и другие факторы, требующие дальнейшего изучения.
КЛАССИФИКАЦИЯ ПОДАГРЫ
Подагру классифицируют по этиопатогенетическому признаку, механизму накопления мочевой кислоты, клиническому течению заболевания и вариантам суставных проявлений.
По этиопатогенетическому признаку выделяют:
— первичную (идиопатическую) подагру;
— вторичную подагру (вызванную другим заболеванием или медикаментами).
По механизму накопления мочевой кислоты подагра может быть:
— метаболического типа;
— гипоэкскреторного типа;
— смешанного типа.
По клиническому течению выделяют следующие формы заболевания (Американская ассоциация ревматологов):
— бессимптомная гиперурикемия;
— острый подагрический артрит;
— подагра с развитием тофусов;
— мочекаменный уролитиаз и другая ассоциированная с подагрой патология почек.
По течению заболевания среди суставных вариантов выделяют:
— острый подагрический артрит;
— интермиттирующий артрит;
— хронический артрит с отложением параартикулярных тофусов.
СИМПТОМЫ ПОДАГРЫ. ПОДАГРИЧЕСКИЙ ПРИСТУП
Клиническая картина при подагре складывается из поражений суставов и комплекса поражений внутренних органов.
Началом подагры считают первый приступ подагрического артрита, хотя нередко до этого типичного клинического проявления данного заболевания может наблюдаться бессимптомная гиперурикемия или развиваться одна или несколько почечных колик, обусловленных уратным нефролитиазом.
Поражение суставов является основным клиническим проявлением подагры. Оно может проявляться острым подагрическим артритом, интермиттирующим артритом или хроническим артритом с отложением параартикулярных тофусов.
Таким образом, можно выделить следующие стадии (периоды) в течении заболевания:
I. Преморбидный период (бессимптомная гиперурикемия), который характеризуется повышением уровня мочевой кислоты в крови без каких-либо клинических симптомов подагры.
II. Острый подагрический артрит.
III. Интермиттирующий (рецидивирующий) артрит.
IV. Хронический подагрический артрит.
V. Хроническая тофусная подагра.
Описание типичного приступа подагры
Описание по данным арубежных источников (Wyngaarten J. [et al.], 1976):
«Жертва идет в кровать и засыпает в хорошем здравии. Около двух часов ночи она просыпается от боли в большом пальце стопы, реже в пятке или голеностопном суставе. Эта боль подобна той, что бывает при вывихе сустава. Другая часть больных сравнивает боль с ощущением холодной воды, льющейся на сустав. Затем следует озноб и ощущение дрожи с невысокой температурой. Боль, которая вначале умеренная, постепенно становится интенсивной. По мере нарастания боли усиливаются озноб и дрожь. Через некоторое время наступает пик атаки, вовлекаются кости и связки плюсны и предплюсны. Теперь это невероятное напряжение связок и ощущение, что последние рвутся на части. Это уже грызущая боль. Так что изысканный и жизнерадостный человек, пораженный болезнью, сбит с ног, он не может одеть отягчающую ночную одежду, не может ходить по комнате, все ему действует на нервы. Ночь проходит в мучениях, без сна, больной постоянно меняет положение, что ведет к непрестанной боли в суставах и ухудшению разразившегося приступа. С этого времени все усилия, направленные на облегчение боли путем смены положения туловища и конечностей, остаются тщетными».
Более чем у половины больных первая атака начинается с моноартрита I плюснефалангового сустава, но со временем этот сустав страдает у 90 % больных подагрой. Часто поражаются также голеностопный, коленный, лучезапястный, суставы кисти и др.
В настоящее время наблюдаются некоторые особенности клинического течения подагры, в частности первого приступа. Они заключаются как в атипичной локализации артрита (локтевые и голеностопные суставы) так и в характере течения в виде острого или подострого полиартрита.
В первые годы болезни поражение суставов протекает по типу острого артрита с полным обратным развитием всех суставных проявлений и восстановлением функций суставов.
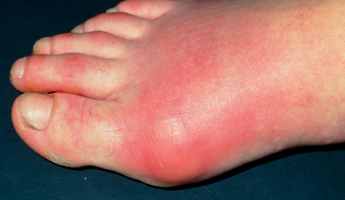
При остром подагрическом приступе в течение нескольких часов пораженный сустав припухает, кожа над ним краснеет, становится горячей, натянутой, блестящей. Больной ощущает легкий озноб, возможно повышение температуры тела до фебрильной. Болевой синдром настолько интенсивен, что часто не купируется анальгетиками. Боль усиливается даже от легкого прикосновения к воспаленной поверхности сустава. Наступает ограничение подвижности в пораженном суставе. К утру интенсивность боли заметно ослабевает.
Продолжительность острой атаки может быть различной и зависит от ее тяжести. Атака средней тяжести заканчивается в течение двух дней, при более тяжелой форме болевой синдром достигает пика за несколько часов и на этом уровне может сохраняться 3 дня, а затем медленно уменьшается в течение 7—10 дней.
Для полного купирования тяжелой атаки может потребоваться несколько недель. У значительного числа больных вторая атака наблюдается в течение следующих 1—2 лет. С годами частота приступов увеличивается, они становятся более продолжительными, но менее острыми. При каждом повторном приступе, как правило, в патологический процесс вовлекаются новые суставы.
Провоцировать новый приступ подагры могут употребление алкоголя или большого количества продуктов, содержащих в высоких концентрациях пуриновые основания, а также нервно-психическое напряжение, физическое переутомление, острые респираторные вирусные инфекции (ОРВИ), переохлаждение, травмы, ушибы, прием лекарственных средств, способствующих развитию гиперурикемии.
Более половины больных указывают на характерные ощущения, которые предшествуют острому приступу подагры. В продромальный период могут наблюдаться психоэмоциональные расстройства (ухудшение настроения вплоть до депрессии, беспокойство, чувство страха, явления повышенной возбудимости, нервозность и др.), возможны диспептические нарушения (потеря аппетита, гиперсаливация, обложенность языка, отрыжка, боли и тяжесть в эпигастрии, неустойчивый стул). У части больных в качестве предвестников могут быть чувство разбитости и ломоты в теле, быстрая утомляемость, дизурические расстройства, боли в области сердца, повышение артериального давления. Многие из перечисленных симптомов и синдромов отмечаются и в период острого приступа.
Можно выделить атипичные формы подагры:
— ревматоидоподобная — симметричные артриты проксимальных межфаланговых суставов кистей;
— периартритическая — локализация процесса в сухожилиях и бурсах при интактных суставах;
— псевдофлегмонозная — моноартрит с ярким воспалением околосуставных тканей, лихорадка.
Интермиттирующая подагра характеризуется возникновением повторных приступов острого подагрического артрита и наличием бессимптомных (светлых) промежутков. Болевой синдром выражен в меньшей степени, чем при остром подагрическом артрите. У больных выявляются тугоподвижность суставов, легкий артикулярный хруст и дефигурация за счет пролиферативных изменений в мягких тканях суставов. Частое повторение приступов с вовлечением многих суставов является прогностически неблагоприятным. Поражение суставов при интермиттирующем подагрическом артрите характеризуется полным обратным развитием всех суставных проявлений и восстановлением функций суставов в межприступном периоде.
ХРОНИЧЕСКИЙ ПОДАГРИЧЕСКИЙ АРТРИТ
Хронический подагрический артрит характеризуется неполной ликвидацией симптомов в пораженных суставах. Инфильтрация суставных тканей уратами сопровождается воспалительной реакцией тканей, окружающих сустав. Спустя 4—6 лет после первого приступа подагры боль и ограничение движений в суставах, припухлость и деформация их становятся более стойкими. На фоне хронического подагрического артрита приступы учащаются, нередко становятся менее острыми, но более продолжительными, чем в раннем периоде болезни.
На фоне хронического подагрического артрита периодически могут возникать острые приступы, продолжающиеся несколько недель. При этом имеет место наиболее тяжелая клиническая картина так называемого подагрического статуса, когда непрерывные интенсивные приступы MOHO-, ОЛИГО- или полиартрита с умеренно выраженной воспалительной реакцией могут наблюдаться до нескольких месяцев!
При этой форме происходит образование тофусов и поражение внутренних органов. К моменту развития тофусов суставной синдром может уже включать деструктивные признаки и деформацию суставов.
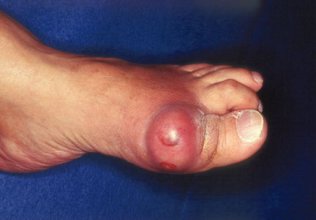
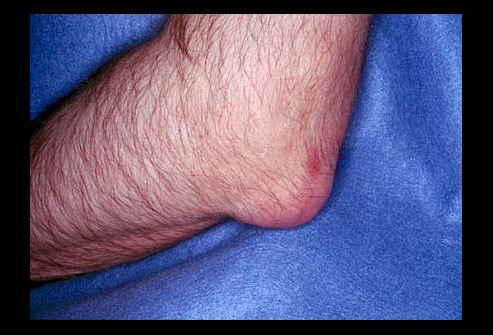
Тофусы (тканевые скопления уратов) обычно возникают через 4—5 лет после появления первых суставных проявлений подагры в виде желтовато-белых зерен. Наиболее частая их локализация - внутренняя поверхность ушных раковин, область локтевых суставов, суставов стоп и кистей, реже они расположены в области коленных суставов, ахиллова сухожилия и др. Возможно обнаружение тофусов на склере и роговице.
Подагрические узелки в ушных раковинах образуются обычно незаметно и неожиданно для больного, в области суставов — чаще после острого подагрического воспаления. Размеры тофусов могут быть от 1—2 мм до 10—12 см в диаметре. Отдельные тофусы могут сливаться, образуя большие конгломераты. При вскрытии из подагрического узла выделяется белая творожистая кашицеобразная масса, состоящая из солей мочевой кислоты. Вскрывшиеся узлы обычно не инфицируются, но заживают медленно. Частота возникновения тофусов прямо пропорциональна длительности болезни.
ДИАГНОСТИКА ПОДАГРИЧЕСКОГО АРТРИТА
Рентгенологигеские проявления при подагре впервые описаны еще в 1896 г. Позднее было проведено множество исследований, которые показали, что на ранней стадии болезни не существует каких-либо характерных рентгенологических изменений. Затем на рентгенограммах появляются признаки деструкции костей и хряща, обусловленные отложением кристаллов урата натрия в субхондральной кости.
Существует несколько классификаций рентгенологических изменений при подагре:
I — крупные кисты в субхондральной кости и в более глубоких слоях. Иногда уплотнение мягких тканей;
II — крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами;
III — большие эрозии, но менее чем на 1/3 суставной поверхности, остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Более поздней является классификация, предложенная М. Cohen, В. Emmerson (1994), согласно которой к основным рентгенологическим признакам при подагре относят следующие:
— в мягких тканях — уплотнения;
— эксцентрическая затемненность, обусловленная тофусами;
— кости (суставы) — суставная поверхность отчетливо представлена;
— юкстаартикулярный остеопороз отсутствует,
— эрозии (пробойник, краевой склероз).
Таким образом, представленные классификации значительно отличаются и нуждаются в унификации ряда рентгенологических признаков при подагре.
Инструментальная и лабораторная диагностика подагры
В клиническом анализе крови во время острых приступов подагры у больных выявляют лейкоцитоз с нейтрофильным сдвигом влево и увеличение СОЭ.
В сыворотке крови определяется повышенное содержание мочевой кислоты: у мужчин более 7 мг % (0,42 ммоль/л), у женщин - 6 мг % (0,36 ммоль/л).
Исследование экскреции мочевой кислоты должно проводиться после 3-дневной диеты, исключающей пурины (мясо, бульоны, рыбу, птицу, бобовые, чай, кофе, какао, алкоголь, пиво). Определяют объем суточной мочи, pH, концентрацию мочевой кислоты и креатинина в моче и сыворотке крови. В норме экскретируется 300-600 мг (1,8—3,6 ммоль/л) мочевой кислоты за сутки.
В содержимом тофусов обнаруживают кристаллы мочевой кислоты. Типичными являются внутрикостные кистовидные образования различных размеров, обусловленные тофусами. Хронический подагрический артрит может сопровождаться деструкцией хряща (сужение суставной щели) и развитием краевых костных эрозий. Характерный признак — «симптом пробойника» — краевые костные или кистовидные образования правильной формы с четкими, иногда склерозированными контурами, с течением времени выраженная деструкция образуется не только в субхондральном участке кости, но и в эпифизе и даже в диафизе, образуя внутрисуставной остеолиз. Рентгенологически наиболее выраженная патология наблюдается в суставах стоп (в первую очередь, в суставах большого пальца). Редко, но могут встречаться рентгенологические изменения в плечевых, тазобедренных, крестцово-подвздошных суставах и позвоночнике.
Костные изменения при подагре редко уменьшаются на фоне проводимой специфической терапии.
Исследование синовиальной жидкости. Существующая в настоящее время литература о составе синовиальной жидкости у больных подагрой свидетельствует о значимости ее исследования для диагностики суставных заболеваний. По мнению многих исследователей, обнаружение кристаллов уратов в синовиальной жидкости и особенно в лейкоцитах является специфичным для подагры. Диагностическое значение имеет обнаружение игольчатых кристаллов уратов, расположенных внутриклеточно и двоякопреломляющих свет при исследовании с помощью поляризационного микроскопа. Пороговая концентрация кристаллов уратов в синовиальной жидкости, еще доступная для идентификации, составляет около 10 мкг/мл. Чувствительность этого теста колеблется в пределах 85—97 %.
Другим важным для острого приступа подагры показателем синовиальной жидкости является ее клеточный состав, главным образом количество лейкоцитов.
ВИСЦЕРОПАТИИ – СОПУТСТВУЮЩАЯ ПАТОЛОГИЯ ВНУТРЕННИХ ОРГАНОВ
Из подагрических висцеропатий наиболее часто встречается поражение почек (у 50—75 % больных), иногда наблюдается гепатопатия, вызванная образованием подагрических узлов в печени.
Риск поражения почек у больных подагрой пропорционален длительности болезни и степени гиперурикемии. Однако в ряде случаев уратная нефропатия может предшествовать развитию суставного синдрома.
Частота поражения почек при подагре по данным разных авторов колеблется в достаточно широких пределах — от 30 до 60—70 %.
Известно, что клиническим проявлением нарушенного пуринового обмена является изолированная уратная нефропатия, часто длительно латентно протекающая и предшествующая подагрическому артриту. Нередко она может оставаться единственным проявлением нарушенного метаболизма пуринов.
Исследования, проведенные в 1980-е годы в институте им. И. М. Сеченова, показали, что нарушение пуринового обмена, в частности длительно сохраняющаяся гиперурикемия, вызывает клинически латентно протекающий гломерулонефрит с преобладанием гематурии и неуклонным прогрессированием в сторону ХПН ( хронической почечной недостаточности).
Таким образом, подагрическая почка — собирательное понятие, включающее всю почечную патологию, наблюдающуюся при подагре: тофусы в паренхиме почек, уратные камни, интерстициальный нефрит, гломерулосклероз и артериолосклероз с развитием нефросклероза.
Диагностика подагры
В 1963 г. в Риме на международном симпозиуме были разработаны критерии диагностики подагры:
1) повышение содержания мочевой кислоты в сыворотке крови (более 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин);
2) тофусы;
3) кристаллы уратов натрия в синовиальной жидкости или тканях, выявленные при микроскопическом или химическом исследовании;
4) острые приступы артрита, возникающие внезапно с полной клинической ремиссией в течение 1—2 нед.
Диагноз подагры устанавливается при наличии двух критериев. Среди перечисленных критериев патогномоничным для подагры является третий признак.
Наличие тофусов, как известно, не является ранним признаком болезни, в силу чего данный признак не столь информативен в первые годы болезни.
Позже были предложены критерии большей диагностической ценности (Wallace S. [et al.], 1977):
А. Наличие характерных мононатриевых уратных кристаллов в синовиальной жидкости.
Б. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
1) максимальное воспаление сустава в 1-й день;
2) наличие более чем 1 атаки артрита;
3) моноартрит;
4) покраснение суставов;
5) боль и воспаление плюснефалангового сустава (ПлФС) I пальца;
6) асимметричное воспаление;
7) одностороннее поражение тарзальных суставов;
8) подозрение на тофусы;
9) гиперурикемия;
10) асимметричное воспаление суставов;
11) субкортикальные кисты без эрозий при рентгенологическом исследовании;
12) отсутствие микроорганизмов в культуре синовиальной жидкости.
Авторы, предложившие эти критерии, подчеркивают, что пять и более признаков встречаются у 95,5 % больных подагрой на ранней стадии болезни.
Подагра лечение и прогноз
Лечение подагры предусматривает дифференциальную стратегию в зависимости от стадии болезни (острая атака или межприступный период, хроническая форма).
Терапия подагры состоит из купирования приступа артрита и мероприятий в межприступный период (профилактика повторных обострений суставного синдрома, лечение внесуставных проявлений подагры — подагрических тендинитов, миозитов, подагрической нефропатии и др.).
Можно выделить 3 основные задачи в лечении этого заболевания:
1) купировать острый приступ как можно быстрее;
2) предотвратить его рецидив;
3) предотвратить или редуцировать проявления хронической подагры (в первую очередь образование тофусов и почечных камней).
Успешное лечение подагры возможно только при совместных усилиях врача и больного. Одной из важных составляющих успеха является соблюдение больным диеты.
Лечебное питание при подагре
При подагре назначается лечебное питание в пределах стола № 6. Эта диета предусматривает исключение продуктов, содержащих большое количество пуринов (200 мкг), ограничение употребления соли (5—8 г), жиров (жиры обладают гиперурикемическим действием); суммарное содержание белков нормальное, но со сниженной квотой животных белков (соотношение между растительными и животными белками приближается к 1:15); достаточное количество витаминов.
В диету включаются щелочные минеральные воды и цитрусовые для усиления выведения из организма уратов.
Пища больному дается в неизмельченном виде, приготовленная на пару или отваренная в воде. Овощи и фрукты употребляются сырыми, в вареном или запеченном виде.
Общее количество свободной жидкости увеличивается до 2,5 л, если нет противопоказаний со стороны сердечно-сосудистой системы. Рекомендуется принимать жидкость в виде чая, клюквенного морса, соков, щелочных минеральных вод. Режим питания дробный, 5—6 раз в день небольшими порциями, в промежутках между приемами пищи — питье.
Рекомендуемые продукты и блюда, входящие в диеты № 6 и № 6е:
1. Хлеб и мучные изделия: хлеб пшеничный, ржаной, ограничиваются изделия из слоеного и сдобного теста.
2. Мясо и птица: нежирные сорта, не более 1—2 раз в неделю в отварном виде. Отваривание мяса и птицы ведет к переходу в бульон до 50 % содержащихся в продуктах пуринов.
3. Рыба: нежирные сорта, 1—2 раза в неделю, в отварном виде.
4. Молочные продукты: молоко, кефир, простокваша, творог, сметана, неострый сыр.
5. Жиры: сливочное, растительное масло.
6. Крупы: в умеренном количестве любые.
7. Овощи: в любой кулинарной обработке, ограничиваются соленые и маринованные овощи.
8. Фрукты и сладкие блюда: любые фрукты и ягоды, свежие и в любой кулинарной обработке; кремы, кисель, мармелад, пастила.
9. Напитки: некрепкий чай, соки, морсы, квас, отвар шиповника, щелочные минеральные воды.
Запрещаются: печень, почки, мозги, язык, мясные копчености, консервы, жирная, соленая, копченая рыба, рыбные консервы, мясные, рыбные, куриные, грибные бульоны, говяжий, свиной и кулинарный жир, бобовые, щавель, шпинат, инжир, шоколад, какао, крепкий чай, кофе.
При сочетании подагры с ожирением назначается гипокалорийный стол № 6е (в рационе сокращается количество хлебобулочных изделий, каш, легко всасывающихся углеводов, жиров).
Больным не рекомендуется полное голодание, так как оно уже в первые дни приводит к увеличению урикемии.
Медикаментозное купирование приступа подагры
Для купирования острого приступа подагрического полиартрита применяют колхицин — препарат безвременника, являющийся мощным ингибитором фосфатазы и тормозящий процессы деления клеток. Рекомендуется строго придерживаться следующих правил при использовании колхицина (Wallace S., Singer J., 1984):
— однократная доза не должна превышать 2 мг, а суммарная — 4 мг (сначала в течение не менее 10 мин вводят 1 мг колхицина, растворенного в 20 мл изотонического раствора хлорида натрия);
— если накануне данный пациент получал колхицин внутрь, применять этот препарат внутривенно не следует; после внутривенного введения полной дозы нельзя применять колхицин ни в каком виде как минимум 7 дней;
— при наличии заболевания почек и печени доза колхицина должна быть уменьшена (на 50 %, если клиренс креатинина ниже 50 мл/мин). Если же этот показатель ниже 10 мл/мин, колхицин не применяют. У пациентов пожилого возраста перед внутривенным применением колхицина желательно исследовать клиренс креатинина;
— следует принимать меры предосторожности для устранения опасности попадания колхицина в близлежащие ткани. Начало действия внутривенно вводимого колхицина отмечается в пределах 6—12 ч.
Существует несколько схем применения колхицина:
1) внутрь по 0,5 мг каждый час до купирования артрита или до достижения максимально допустимой дозы — 6 мг;
2) внутрь по 1,0 мг через каждые 3 ч до достижения максимально допустимой дозы — 10 мг;
3) более безопасная схема:
1-й день — колхицин внутрь по 1 мг 3 раза в сутки после еды;
2-й день — по 1 мг утром и вечером, затем по 1 мг в сутки.
Улучшение наступает обычно в течение 12 ч от начала лечения. Действие колхицина чрезвычайно специфично для подагры (ни при каком другом артрите препарат не оказывает такого купирующего эффекта, как при подагре). Препарат эффективен у 90 % больных. Наиболее часто отсутствие лечебного эффекта обусловлено поздним применением препарата.
Колхицин вызывает побочные явления со стороны ЖКТ (диарея, тошнота, реже — рвота), вследствие чего приходится снижать дозу или даже отменять препарат. Диарея может быть упорной и мучительной, и чтобы предотвратить ее, одновременно с колхицином назначают препараты висмута.
Абсолютным противопоказанием для назначения колхицина является сочетание почечной и печеночной недостаточности, выраженное снижение клубочковой фильтрации и внепеченочная билиарная обструкция.
При длительном лечении колхицином возможно развитие анемии, лейкопении.
Значительно меньше токсичность и частота побочных явлений у НПВП, которые также используются для лечения подагрических атак. Широкое применение в клинической практике нашли препараты пиразолонового (бутадион, реопирин, кетазол, фенилбутазон) и индольного (индометацин, метиндол) рядов.
Для купирования острого подагрического артрита НПВП применяются в больших дозах, но даже при таком применении они переносятся лучше, чем колхицин. Кроме того, в случае развития побочных эффектов или непереносимости одного из этих препаратов его можно заменить другими, при этом нередко достигается более выраженное лечебное действие.
Широко применяется для купирования подагрической атаки вольтарен, который назначается в первые сутки по 200 мг, а затем по 150 мг/сут. Преимуществом препарата является его хорошая переносимость и нарастание клинического эффекта по мере увеличения дозы. Вольтарен можно вводить и внутримышечно по 3 мл 1—2 раза в сутки, что особенно актуально при сопутствующих заболеваниях желудочно-кишечного тракта. Весьма эффективно применение пролонгированных форм препаратов: вольтарен-ретард, метиндол-ретард и др.
По безопасности, с учетом развития побочных эффектов, особенно со стороны желудочно-кишечного тракта, предпочтение отдается селективным ингибиторам ЦОГ-2 (нимесулид, мелоксикам).
Хороший эффект применения ГКС при остром приступе известен давно, данный метод считается безопасным и показан при невозможности применения НПВП или колхицина из-за непереносимости этих препаратов, наличия почечной недостаточности, язвенного поражения желудочно-кишечного тракта.
ГКС можно использовать в следующих вариантах:
1) преднизолон 40—60 мг в первые сутки (таблетированная форма), с последующим снижением дозы по 5 мг через день;
2) триамцинолон в/м 60 мг, при необходимости введение повторить через 24 ч;
3) метилпреднизолон в/в 50—150 мг, а также в тяжелых случаях в варианте малой пульс-терапии: однократно 250—500 мг ;
4) периартикулярное или внутрисуставное (при обязательном исключении септического артрита) введение ГКС (дипроспан, гидрокортизон).
Лечение хронического подагрического артрита
При долговременной терапии подагры для предотвращения повторных приступов полиартрита необходимо добиться снижения в плазме уровня мочевой кислоты. Противоподагрическая (длительная, базисная) терапия проводится у пациентов с частыми (3—4 раза в год) приступами артрита и особенно с хронической тофусной подагрой и нефролитиазом. Важными показаниями для начала терапии являются также стойкая гиперурикемия, даже при наличии в анамнезе одного приступа артрита, или сокращение промежутков между приступами.
В настоящее время применяются две группы лекарственных веществ: урикозурические препараты, способствующие увеличению экскреции мочевой кислоты почками, и урикодепрессивные препараты, снижающие ее синтез.
Аллопуринол ингибирует фермент ксантиноксидазу, в результате чего нарушается цикл биохимических реакций превращения гипоксантина в мочевую кислоту. Содержание ее в крови снижается, одновременно снижается урикозурия, поэтому нет риска образования уратных камней в мочевых путях. Препарат можно применять и при наличии почечной патологии (но без выраженной почечной недостаточности). Метаболит аллопуринола оксипуринол тоже ингибирует ксантиноксидазу.
Показаниями для назначения аллопуринола являются:
— достоверный диагноз хронического подагрического артрита;
— гиперэкскреция мочевой кислоты (более 800 мг/сут — без диеты и более 600 мг — на малопуриновой диете);
— поражение почек со снижением клиренса креатинина ниже 80 мл/мин;
— образование тофусов в мягких тканях и субхондральной кости;
— нефролитиаз;
— стойкое увеличение уровня мочевой кислоты более 13 мг % у мужчин и более 10 мг % у женщин;
— противопоказания к назначению урикозурических препаратов;
— проведение цитотоксической терапии или рентгенотерапии по поводу лимфопролиферативных заболеваний;
— подагра, не контролируемая урикозурическими агентами и колхицином, манифестирующая продленными атаками или неконтролируемой гиперурикемией;
— выявление признаков подагрической нефропатии.
Аллопуринол выпускается в таблетках по 0,1 и 0,3 г.
Необходимо придерживаться следующих основных принципов при лечении аллопуринолом:
1. Не рекомендуется начинать терапию аллопуринолом при наличии острой суставной атаки, необходимо купировать суставной синдром. Если же приступ развился на фоне терапии аллопуринолом, то можно снизить дозу и не отменять препарат полностью. 2. Для профилактики острых приступов артрита, иногда возникающих в начале приема препарата, и возникновения аллергических и тяжелых побочных реакций рекомендуется начинать терапию с небольшой дозы (чаще 100 мг в сутки). Отражением правильного подбора дозы препарата является скорость снижения уровня гиперурикемии не более 0,6—0,8 мг% или 0,1—0,6 мг/дл, или 10 % от исходных цифр в течение 1 мес. терапии.
3. Для профилактики острого приступа в начале приема аллопуринола возможно применение низких доз колхицина или НПВП.
4. При отмене аллопуринола уровень мочевой кислоты нарастает быстро (в течение 3—4 дней).
5. Следует помнить, что во время приступа артрита уровень мочевой кислоты обычно ниже, чем в межприступном периоде, поэтому требуются повторные исследования ее уровня уже после купирования артрита.
Начальная доза препарата составляет 50—100 мг/сут, затем ежедневно суточную дозу увеличивают на 100 мг и доводят до 200—300 мг при легких формах заболевания и до 400-500 мг при формах средней тяжести и тяжелых.
Уровень мочевой кислоты в крови начинает снижаться на 2—3-й день и достигает нормальных цифр на 7—10-й день. По мере снижения урикемии снижается дозировка аллопуринола, стойкая и полная нормализация урикемии обычно наступает через 4—6 мес., после чего назначается поддерживающая доза аллопуринола — 100 мг/сут.
Урежение и уменьшение интенсивности приступов, размягчение и рассасывание тофусов наблюдается через 6—12 мес. непрерывного лечения аллопуринолом. После продолжительного лечения могут полностью исчезнуть и хронические суставные проявления. Лечение аллопуринолом продолжается многие годы, практически непрерывно.
Переносимость аллопуринола хорошая, в редких случаях возможны побочные явления:
— аллергические реакции (зуд, кожные высыпания, аллергический отек Квинке, васкулит);
— диспептические явления;
— повышение температуры тела;
— острая почечная недостаточность;
— агранулоцитоз;
— синдром Стивена — Джонсона.
Во время лечения аллопуринолом необходимо обеспечивать диурез в пределах 2 л и слабощелочную реакцию мочи, чтобы избежать образования ксантиновых камней (при ощелачивании мочи гипоксантин и ксантин сохраняются в растворенном состоянии).
Противопоказания к применению аллопуринола:
— выраженные нарушения функции печени,
— гемохроматоз,
— беременность,
— детский возраст (кроме злокачественных заболеваний с гиперурикемией).
Тиопуринол производное аллопуринола в таблетках по 0,1 г.
Препарат угнетает синтез мочевой кислоты, ингибирует глутаминфосфорибозилтрансферазу, так же активен, как аллопуринол, но гораздо лучше переносится больными. Применяется в суточной дозе 300-400 мг.
Физиотерапевтическое лечение в остром периоде подагры ограничено.
Ультрафиолетовое облучение сустава в эритемной дозе, начатое в максимально ранние сроки, до появления припухлости и покраснения сустава, позволяет иногда оборвать начинающийся приступ.
Используют фонофорез с кальцием, димедролом; ионофорез с литием; рефлексотерапию, точечный массаж, транскраниальную стимуляцию опиоидных структур.
Физиотерапевтическое лечение в межприступном периоде подагры включает диатермию, грязевые и парафиновые аппликации. Фонофорез с гидрокортизоном оказывает выраженное противовоспалительное действие. Поступивший с помощью процедуры гидрокортизон в связи с иммуносупрессивным действием способствует ослаблению воспалительного процесса, усилению местного крово- и лимфообращения, ускорению выведения кристаллов уратов из пораженных тканей. Фонофорез с гидрокортизоном способствует также улучшению функции почек, удалению уратов из организма и снижению их уровня в крови. Курс лечения — 6—8 процедур.
Теплолечение (аппликации грязи, парафина, озокерита, сочетание грязевых аппликаций с индуктотермией) способствует значительному улучшению функции суставов, уменьшает боли и воспалительные процессы в околосуставных тканях, снижает в них содержание уратов.
Теплолечение особенно эффективно при сочетании хронического подагрического полиартрита с остеоартрозом, при деформациях суставов. Курс лечения составляет 6—8 процедур.
В комплексном лечении целесообразно проведение бальнеотерапии, использование радоновых, сероводородных, йодобромных хлоридно-натриевых ванн.
Бальнеотерапия больных подагрой проводится в межприступном периоде. Бальнеопроцедуры способствуют улучшению системы микроциркуляции, оказывают урикозурическое действие, улучшают трофику тканей и синовиальной оболочки, улучшают кровоснабжение в тканях пораженных суставов. Это в свою очередь способствует удалению солей мочевой кислоты из синовиальных оболочек и тканевых депо. Под влиянием бальнеолечения уменьшаются воспалительные явления в суставах, снижается активность лизосомальных ферментов, повышаются функциональные возможности печени и почек, улучшаются показатели пуринового и липидного обменов.
Радоновые ванны. Основным действующим фактором при приеме радоновых ванн является (х-излучение. Радон проникает в организм через кожу и легкие, что обусловливает внутреннее облучение организма. На коже больного осаждаются продукты распада радона, образуется активный налет, осуществляющий наружное облучение кожи. Радоновые ванны нормализуют обмен мочевой кислоты, улучшают функцию печени, благоприятно влияют на липидный обмен, нормализуют АД, улучшают кровообращение в тканях пораженных суставов.
Радоновые ванны оказывают аналгезирующее, седативное, противовоспалительное действие. Радоновые ванны назначаются с концентрацией радона 1,5 кБк/л, температурой 36—37 °С, продолжительностью 10—15 мин два дня подряд с последующим днем перерыва или три дня подряд, 4 или 5 ванн в неделю; курс лечения — 12—14 ванн.
Сероводородные ванны. Специфическое действие этих ванн обусловлено сероводородом, поступающим, главным образом, через кожу. Сероводород положительно влияет на печень, что отражается на состоянии пуринового и других видов обмена. Сероводородные ванны усиливают микроциркуляцию, трофические процессы в тканях суставов, улучшают питание хряща, снижают уровень мочевой кислоты в крови, оказывают урикозурическое действие. Назначают сероводородные ванны с концентрацией 50—100 мг/л, температурой 36—37 °С, продолжительностью 10—15 мин, два дня подряд с последующим днем перерыва; курс лечения — 10—12 процедур.
Йодобромные хлоридно-натриевые ванны оказывают воздействие на организм через рецепторы кожи. Микроэлементы йод и бром, образуя депо в коже, частично проникают в гуморальную среду организма. Входя в состав различных ферментных систем, они влияют на обменные процессы. Натрия хлорид, являющийся основным минеральным компонентом йодобромных хлоридно-натрие-лававых ванн, способствует проникновению йода и брома внутрь организма. Йодобромные ванны положительно влияют на нервную, сердечно-сосудистую, симпатоадреналовую и гипофизарно-надпочечниковую системы, стабилизируют мембраны гепатоцитов, улучшают функцию почек, увеличивают экскрецию уратов, снижают уровень уратов в крови, нормализуют показатели липидного обмена. Йодобромные ванны, оказывая противовоспалительное, антитоксическое и бактерицидное действие, способствуют быстрому очищению и рубцеванию тофусов, хорошо переносятся больными. У пациентов быстро стихают боли, уменьшаются тофусы, снижаются признаки воспалительных явлений.
Йодобромные ванны показаны больным подагрой в фазе ремиссии, а также при сочетании подагры с гипертонической болезнью 1—2 ст., ожирением, мочекаменной болезнью, ИБС не выше II ФК без нарушения сердечного ритма. Йодобромные ванны назначаются с содержанием натрия хлорида 20 г/л, йода — 10 г/л, брома — 25 г/л; температура ванны — 37°С, продолжительность процедуры — 10—15 мин, два дня подряд с последующим днем перерыва. При хорошей переносимости ванн больным применяют 5 ванн в неделю, на курс лечения 10—12 ванн.
Йодобромные ванны в комплексе с фонофорезом гидрокортизона применяются для лечения подагры в фазе неполной ремиссии, фонофорез гидрокортизона в этом случае уменьшает риск обострения в ходе лечения, снижает активность воспаления и улучшает функциональное состояние суставов.
Противопоказаниями к разного вида ваннам являются:
— острый приступ подагры;
— фаза неполной ремиссии;
— нарушения функции почек, печени;
— хронический гепатит;
— желчнокаменная и мочекаменная болезнь.
Больным подагрой проводится плазмаферез — 3—4 сеанса через каждые 6 мес.
Оценка эффективности терапии определяется снижением уровня мочевой кислоты в сыворотке крови, уменьшением частоты приступов подагры, рассасыванием тофусов, отсутствием прогрессирования уролитиаза, снижением потребности в НПВП, колхицине, ГКС.
Прогноз при подагрическом артрите в целом благоприятный. Прогностически неблагоприятными факторами считаются:
— развитие заболевания в возрасте до 30 лет;
— стойкая гиперурикемия более 0,6 ммоль/л;
— стойкая гиперурикозурия более 1100 мг/сут;
— наличие мочекаменной болезни в сочетании с инфекцией мочевых путей;
— прогрессирующая нефропатия, особенно в сочетании с сахарным диабетом и артериальной гипертензией.
В 20—50 % случаев развивается уролитиаз, а почечная недостаточность является причиной смерти в 18—25 % случаев.
Для получения более подробной информации пожалуйста пройдите по ссылке
Подробнее о лечении подагры
Консультация по поводу лечения методами традиционной восточной медицины (точечный массаж, мануальная терапия, иглоукалывание, фитотерапия, даосская психотерапия и другие немедикаментозные методы лечения) проводится в Центральном районе Санкт-Петербурга (7-10 минут пешком от станции метро «Владимирская/Достоевская»), с 9.00 до 21.00, без обеда и выходных.
Уже давно известно, что наилучший эффект в лечении заболеваний достигается при сочетанном использовании «западных» и «восточных» подходов. Значительно уменьшаются сроки лечения, снижается вероятность рецидива заболевания. Поскольку «восточный» подход кроме техник направленных на лечение основного заболевания большое внимание уделяет «чистке» крови, лимфы, сосудов, путей пищеварения, мыслей и др. – зачастую это даже необходимое условие.
Консультация проводится бесплатно и ни к чему Вас не обязывает. На ней крайне желательны все данные Ваших лабораторных и инструментальных методов исследования за последние 3-5 лет. Потратив всего 30-40 минут Вашего времени вы узнаете об альтернативных методах лечения, узнаете как можно повысить эффективность уже назначенной терапии, и, самое главное, о том, как можно самостоятельно бороться с болезнью. Вы, возможно, удивитесь - как все будет логично построено, а понимание сути и причин – первый шаг к успешному решению проблемы!